過去問と解説を日々更新していきたいと思います。まずおすすめの勉強方法
① まず物理、化学、生物の基本的な単語の定義は覚えておく必要がある。
② 過去問を解きまくる。過去問こそ最大の教科書である。直近の過去5年分は解かずに置いておき、模擬試験形式できちんと解けるように残しておく。
③ 解いた問題は自分のノートに書いてまとめると良い。問題を解いてノートにそれをまとめることで、間違えたとき見直しがしやすく、より覚えがよくなります。
④ 物・化・生の問題は最初解かずに過去5年以上の問題を全て写し、それを自分の教科書として覚える方が良い。
⑤ 管理・計測(実務)も同じことが言える。最初写すのはものすごく大変だが、参考書にも載っていないようなことが書かれているため勉強の効率は逆にいいと考える。
⑥ 法令に関しては私がまとめた資料を覚えていただくと7割の問題は解けると思 う。残りの3割は問題を解いていきながら徐々に覚えていく方が望ましい。また法令を覚えるの は試験の3~4ヵ月前でいいかと思います。やってないと忘れるため。
下記のサイトに私がまとめた資料を示しております。
第1種放射線取扱主任者まとめ集
下の解説は一部なのでまとめたものが欲しい方は上記サイトまで。
問1
次のうち、単核種元素(安定同位体が1つの元素)のみの組み合わせはどれか。
A He, F, Na
B Al, P, Cl
C As, Y, Sn
D Sc, Mn, Co
E I, Cs, Au
1 AとB 2 BとC 3 CとD 4 DとE 5 AとE
解答
A He, F, Na・・・3He, 4He, 19F, 23Na Heの安定同位体が2つ存在する。
B Al, P, Cl・・・27Al, 31P, 35Cl, 37Cl Clの安定同位体が2つ存在する。
C As, Y, Sn・・・75As, 89Y, 112Sn, 114Sn, 115Sn,・・・とSnには安定同位体が多数存在する。
D Sc, Mn, Co・・・45Sc, 55Mn, 59Co それそれ安定同位体が1つである。
E I, Cs, Au・・・127I, 133Cs, 197Au それそれ安定同位体が1つである。
したがって解答は 4 となる。
詳しくは私が作ったまとめ表に載せていますので是非上記まで。
問2
次のうち、β-壊変する核種のみの組み合わせはどれか。
A 18F, 32P, 33P
B 45Ca, 51Cr, 60Co
C 57Co, 63Ni, 82Br
D 85Kr, 99Mo, 131I
E 137Cs, 147Pm, 192Ir
1 AとB 2 BとC 3 CとD 4 DとE 5 AとE
解答
私がまとめた表をしっかり覚えていただけたらと思います。
A 18F・・・β+壊変, 32P・・・β-壊変, 33P・・・β-壊変。
B 45Ca・・・β-壊変, 51Cr・・・EC壊変, 60Co・・・β-壊変。
C 57Co・・・EC壊変, 63Ni・・・β-壊変, 82Br・・・β-壊変。
D 85Kr・・・β-壊変, 99Mo・・・β-壊変, 131I・・・β-壊変
E 137Cs・・・β-壊変, 147Pm・・・β-壊変, 192Ir・・・β-壊変、EC壊変
したがって解答は 4 となる。
問3
次のうち、γ線を放出しない核種の組み合わせはどれか。
1 3H, 36Cl, 59Fe
2 14C, 35S, 38Cl
3 32P, 33P, 45Ca
4 7Be, 33P, 35S
5 38Cl, 59Fe, 63Ni
解答
私がまとめた表をしっかり覚えていただけたらと思います。
1 3H・・・β-壊変, 36Cl・・・β-壊変, 59Fe・・・β-壊変、γ線。
2 14C・・・β-壊変, 35S・・・β-壊変, 38Cl・・・β-壊変、γ線
3 32P・・・β-壊変, 33P・・・β-壊変, 45Ca・・・β-壊変。
4 7Be・・・EC、γ線, 33P・・・β-壊変, 35S・・・β-壊変
5 38Cl・・・β-壊変、γ線, 59Fe・・・β-壊変、γ線, 63Ni・・・β-壊変
したがって解答は 3 となる。
問4
アクチノイド元素とランタノイド元素に関する次の記述のうち、正しいものの組み合わせはどれか。
A アクチノイド元素は、全てが放射性である。
B ランタノイド元素は全てが安定同位体である。
C ランタノイド元素、原子番号が増すと原子半径が小さくなる。
D アクチノイド元素は、3価の状態が最も安定である。
1 AとB 2 AとC 3 BとC 4 BとD 5 CとD
解答
原子番号82の鉛Pb以上の元素は、総べて天然の放射性核種をもち、特に原子番号84のポロニウム以上の元素は安定核種がなく総べて放射性である。またランタノイド元素では、原子番号が増すと、原子半径、イオン半径が小さくなる。アクチノイド元素の中のアメリシウムAmより重い元素は、3価をとる場合がほとんどであるが、アメリシウムAmより軽い元素は3価と異なる原子価をとる。
したがって、解答は 2 となる。
問5
放射性元素に関する次の記述のうち、正しいものの組み合わせはどれか。
A テクネチウムはTc、レニウムReの同族元素である。
B プロメチウムPmは、アクチノイド元素である。
C ラドンRn、ヘリウムHeの同族元素である。
D ラジウムRaは、ナトリウムの同族元素である。
1 AとB 2 AとC 3 BとC 4 BとD 5 CとD
解答 これも周期表を覚えておかないと解けない問題である。周期表より解答は 2 となる。
問6
11Cが1TBq、14Cが1MBqある。100分後の11C/14C原子数の比として最も近い値は、次のうちどれか。
ただし、11Cと14Cn半減期は、それぞれ20分、3.0 × 10^9 分とする。
1 2 × 10^(-13)
2 2 × 10^(-8)
3 2 × 10^(-4)
4 2 × 10^(3)
5 2 × 10^(12)
解答
原子数 N の放射性核種の放射能 A とその壊変定数 λ と半減期 T の関係式は A= λN = (0.693/T)・N
ここから N = AT/0.693 となる。
ここで、11C、14Cの100分後の放射能を求めると、A(11C)100分後 = 1TBq × (1/2)^5 ≒ 3 × 10^10
14Cの半減期は3.0 × 10^9 分 と半減期が非常に長いので、放射能はほぼ変わらない。
したがって、11C/14C = (3 × 10^10 × 20分)/(1 × 10^6 × 3 × 10^9分 ) = 2 × 10^(-4)
したがって、解答は 3 となる。
問7
238U を40g 含む岩石中の222n の放射能(Bq)として最も近い値は、次のうちどれか。ただし、岩石中のウラン系列核種は永続平衡であり、U238の比放射能は1.2 × 10^4 (Bq/g)とする。
1 1.2 × 10^4
2 4.8 × 10^4
3 1.2 × 10^5
4 4.8 × 10^5
5 1.2 × 10^6
解答
永続平衡が成り立っているので N1λ1 = N2λ2 A1 = A2 の関係となる。
よって、A(222Rn) = A(238U) =1.2 × 10^4 × 40 = 4.8 × 10^5 Bq となる。
したがって、解答は 4 となる。
問8
半減期 T1 の親核種の壊変により半減期 T2 の娘核種が生成する。時間が十分に長く経過した後、(>10T2)、両核種の関係に関する次の記述のうち、正しいものの組み合わせはどれか。
A T1>>T2 では、親核種と娘核種の壊変率が等しくなる。
B T1>T2 では、親核種と娘核種の壊変率の比がほぼ一定となる。
C T1>T2 では、親核種の壊変率は娘核種の壊変率より常に大きくなる。
D T1<T2 では、親核種と娘核種の原子数の比がほぼ一定となる。
1 AとB 2 AとC 3 BとC 4 BとD 5 CとD
解答
過度平衡の場合 λ1 < λ2、すなわち、T1 > T2 → N2/N1 = λ1/(λ2-λ1)・・・①
①より、N2(λ2-λ1) = N1λ1 より N2λ2 = N1λ1 + N2λ1・・・②
ここで、A2/A1 = N2λ2/N1λ1に②を代入するとA2/A1 = (N1λ1 + N2λ1)/N1λ1 = 1 + N2λ1/N1λ1 > 1 となることがわかる。
永続平衡の場合 λ1<<λ2、すなわち、T1>>T2 → N1λ1 = 1 よってA2 = A1
A T1>>T2 では、親核種と娘核種の壊変率が等しくなる。・・・永続平衡が成り立つので壊変率は等しくなる。
B T1>T2 では、親核種と娘核種の壊変率の比がほぼ一定となる。・・・過度平衡が成り立ちA2/A1 = 1 + N2λ1/N1λ1 と一定となる。
C T1>T2 では、親核種の壊変率は娘核種の壊変率より常に大きくなる。・・・A2 = 1 + (N2λ1/N1λ1) × A1となり
親核種の壊変率は娘核種の壊変率より常に小さくなる。
D T1<T2 では、親核種と娘核種の原子数の比がほぼ一定となる。・・・T1<T2 では放射平衡は成り立たない。
したがって、解答は 1 となる。
問9
次の核反応のうち、18Fを生じるものの組み合わせはどれか。
A 16O(3He,n)
B 18O(p,n)
C 14N(α,n)
D 20Ne(d,α)
1 AとB 2 AとC 3 BとC 4 BとD 5 CとD
解答 これは原子番号と放出核種を覚えて、計算すれば解ける問題である。
したがって、解答は 4 となる。
問10
コバルト1 mg (原子数は1.0 × 10^19個)を原子炉で24時間照射した。照射終了直後の60Coの放射能は3.7 MBq であった。
熱中性子フルエンス率(/cm・s)として最も近い値は、次のうちどれか。ただし60Coの半減期は5.3年、熱中性子放射化断面積は37バーンとする。
1 5.4 × 10^9
2 1.0 × 10^10
3 3.7 × 10^11
4 1.0 × 10^13
5 2.7 × 10^13
解答
t時間照射して照射終了後得られる半減期T、壊変定数λの生成核の放射能Aは、熱中性子フルエンス率fと放射化断面積σを用いて表わすと、次のような式となる。A = Nfσ[1 – (e^(-ln2・t/T) )] ここでt/T = 1日/19000日 << 1となるため、e^(-ln2・t/T) ≒ 1 – 0.693t/T となり、f = (A/σN) × T/0.693t ≒ 2.7 × 10^13(/cm・s) となる。
したがって解答は 5 となる。
問11
地球上の14Cは、主として宇宙線起源の中性子による14N(n,p)14C反応により生成する。地球全体での生成量を年8kg(1.3 × 10^15 Bq/年)とすると、地球上に存在する宇宙線起源の14Cの質量(kg)として最も近い値は、次のうちどれか。ただし14Cの半減期は5730年とする。
1 1.1 × 10^4
2 3.2 × 10^4
3 4.6 × 10^4
4 6.6 × 10^4
5 1.1 × 10^5
解答
使う公式としてはAn = A × [1 – (1/2)^(n/T)/(0.693/T)] を用いる。
ここで、14Cの半減期が5730年、nは地球の形成年代程度で非常に大きいので(1/2)^(n/5730) = 0 と考えられるので、
An = 1.3 × 10^15Bq × [1 – 0]/(0.693/5730) =1.07 × 10^19 Bq である。地球上に存在する宇宙線起源の14Cの質量をMとすると、1.3 × 10^15/8 = 1.07 × 10^19/M M = 6.6 × 10^4kg
したがって、解答は 4 となる。
問12
原子炉での中性子照射により、無担体の放射性同位体として製造されるものの組み合わせは、次のうちどれか。
A 3H
B 11C
C 32P
D 35S
1 ABCのみ 2 ABDのみ 3 ACDのみ 4 BCDのみ 5 ABCDすべて
解答
RIがその安定同位体を含まないで存在している状態のことを無担体であるという。
生成核の原子番号が核反応によって変わらない場合、生成した核種は常に非放射性のターゲットによってうすめられるため、無担体のRIを製造できない。原子炉は主に(n,γ)反応しか利用できないので、本質的には、無担体RIを作ることは無理である。しかし、ターゲットと異なる原子番号のRIが生成する核反応であれば、化学的に目的のRIを分離できるので、無担体のRIが製造できる。
A 3H・・・3He(n,p)3H 軽元素のターゲットである3Heに対しては、熱中性子(0.025eV)のような低エネルギー中性子でも核反応は起こる。
B 11C・・・11B(p,n)11C、14N(p,α)11C という陽子によって起こるため、中性子照射によらない。
C 32P・・・33S(n,p)32P、D 35S・・・35Cl(n,p)35S とともに(n,p)型の核反応であり、広い範囲の原子番号のターゲットに対し、0.1MeVから数MeV程度のエネルギーの中性子によって起こる。
したがって、解答は 3 となる。
問13
次のうち、中性子源として用いられる組み合わせはどれか。
A 60Co - 9Be
B 90Sr ー 9Be
C 137Cs ー 9Be
D 226Ra ー 9Be
E 241Am ー 9Be
1 AとB 2 AとE 3 BとC 4 CとD 5 DとE
解答
中性子源は核反応により中性子を放出する核種または自発核分裂により中性子を放出する核種が用いられる。9Be(α,n)12C 反応を用い、α線源として241Am,226Ra を用いるのが代表的である。
したがって、解答は 5 となる。
問14
210Poに関する次の記述のうち、正しいものの組み合わせはどれか。
A 210Po は S の同族元素である。
B ウラン系列の核種である。
C 210Bi の娘核種である。
D α壊変して 206Pb となる。
1 ABCのみ 2 ABDのみ 3 ACDのみ 4 BCDのみ 5 ABCDすべて
解答
これは全て正しい。この問題も周期表を覚えておかないと解けない問題である。
解答は 5 となる。
問15
232Th 900gの放射能(MBq)として最も近い値は、次のうちどれか。ただし232Th の半減期は1.4 × 10^10 年(4.4 × 10^17 秒)
アボガドロ定数6.0 × 10^23 /molとする。
1 0.037
2 0.53
3 3.7
4 53
5 370
解答
質量Wグラム、原子量Nと質量数Mの放射性核種の放射能Aとその壊変定数λと半減期Tの関係式は
A = Nλ = (ln2/T) × (W/M×6.0 × 10^23) となり、代入して計算するとA(232Th) ≒ 3.7 MBq
解答は 3 となる。
問16
次の放射線試料と検出器の組み合わせのうち、試料の測定に適したものはどれか。
A 32Pが付着したろ紙 ー GM計数管
B 3H標識化合物を含む水溶液 ー 液体シンチレーション検出器
C 99mTcで標識された化合物を含む溶液 ー 井戸型NaI(Tl)シンチレーション検出器
D 60Coを含むステンレス板 ー Ge検出器
1 ABCのみ 2 ABDのみ 3 ACDのみ 4 BCDのみ 5 ABCDすべて
解答
32Pは高エネルギーのβ線放出核種である。端窓型GM計数管では低エネルギーは通過できないが、高エネルギーβ線は通過可能なので測定できる。3Hや14Cは低エネルギーβ線を放出し、液体シンチレーションはこうした低エネルギーβ線を高感度で測定可能である。
99mTcは0.141MeVのγ線を放出し、MaI(Tl)シンチレーション検出器はγ線の測定に用いられる代表的な検出器である。また、60Coの放出核種はβ-線及び1.173MeVと1.333MeVの2本のγ線を放出する。Ge検出器は主にγ線の検出に用いられるため、.173MeVと1.333MeVの2本のγ線が
検出可能である。
したがって、解答は 5 となる。
問17
放射性気体に関する次の記述のうち、正しい組み合わせはどれか。
A ウラン鉱石を酸に溶解すると放射性気体が発生する。
B 14Cで標識された炭酸カルシウム粉末に水酸化カルシウム水溶液を滴下すると、放射性気体が発生する。
C 熱中性子に照射された空気には、放射化されたアルゴンが含まれる。
D 125I-のアルカリ性水溶液に酸を加えていくと、放射性気体が発生する。
1 ABCのみ 2 ABDのみ 3 ACDのみ 4 BCDのみ 5 ABCDすべて
解答
A ウラン鉱石に酸を溶解すると、220Rnが散逸する。
B CaCO3 + 2HCl → CaCO3 + H2O + CO2↑ このように塩酸を加えると[14C]O2を含む二酸化炭素が発生する。
C 熱中性の照射により、空気中に主として空気を構成している窒素、酸素、アルゴンが放射化されて12N,16N,14C,41Arが放射化生成物となる。
D 125I-のアルカリ性水溶液に酸を加えることで、揮発しやすい放射性の125I2が発生する。
したがって、解答は 3 となる。
問18
溶媒抽出法に関する次の記述のうち、正しい組み合わせはどれか。
A 125I-をI2と同位体交換させて有機溶媒に抽出する。
B 65Zn2+をジチゾン錯体として有機溶媒に抽出する。
C 59Fe3+をクロロ錯体としてイソプロピルエーテルに抽出する。
D 137Cs+をクエン酸錯体として有機溶媒に抽出する。
1 ABCのみ 2 ABDのみ 3 ACDのみ 4 BCDのみ 5 ABCDすべて
解答
A ヨウ化物イオン125I-を含む溶液を、ヨウ素単体I2を含む四塩化炭素溶液と振り混ぜると、125I-とI2が同位体交換して、四塩化炭素溶液に移るため、抽出可能である。
B ジチゾンは多数の金属と安定な錯体を生成する。その錯体の有機溶媒への抽出率はpH依存性がある。また、マスキング剤を用いることで目的金属を抽出することが可能となり、Bも正しい。
C Fe3+を含む7.7Mから8M塩酸溶液を分液漏斗に入れ、同容量のジイソプロピルエーテルを加えて溶媒抽出すると、Fe3+は塩酸溶液中でクロロ錯体HFecL4を作り、イオン会合して100%近くジイソプロピルエーテルに抽出されるため、Cも正しい
D Csはアルカリ金属に属しており、クエン酸等のオキソカルボン酸と錯体を形成する。しかし、アルカリ金属のクエン酸錯体は水に可溶性であり、有機溶媒には抽出されない。
したがって、解答は 1 となる。
問19
蒸留による分離法に関する次の記述のうち、正しい組み合わせはどれか。
A 35SをH2Sとして蒸留することができる。
B 36ClをHClとして蒸留することができる。
C 74AsをAsH3として蒸留することができる。
D 83BrをBr2として蒸留することができる。
1 ABCのみ 2 ABDのみ 3 ACDのみ 4 BCDのみ 5 ABCDすべて
解答
蒸留法とは色々な成分が混じっている溶液を加熱するとき、出てくる蒸気の組成は、元の溶液の組成とは異なり揮発成分が多く含まれる。この現象を利用して液体混合物から各成分を分離する操作をいう。
表の一覧を示す。表より解答は 5 となる。
| 元素 |
蒸留する化合物 |
操作条件 |
| As |
AsH3,AsCl3,AsBr3 |
発生期のH2で還元(AsH3),HCl+H2SO4,HBr+H2SO4 |
| B |
B(OCH3) |
H2SO4+CH3OHで加熱 |
| Br |
Br2 |
K2CrO4+H2SO4で加熱 |
| Cr |
CrO2Cl4 |
HCl+HClO4で加熱 |
| F |
H2SiF4 |
SiO2+H2SO4で加熱 |
| Ge |
GeCl4 |
HCl+HNO3+HClO4で加熱 |
| HG |
Hg,HgCl2 |
還元加熱でHg,HCl+H2SO4で加熱 |
| S |
H2S,SO2 |
硫化物+HClで加熱(H2S),燃焼でSO2 |
| Sb |
SbCl3,SbBr3 |
HCl+H3PO4,HBr+H2SO4で加熱 |
| Si |
SiF4 |
HF+H2SO4で加熱 |
| Se |
SeBr4,SeO2 |
HBr+H2SO4で加熱,HNO3+H2SO4で加熱 |
| Sn |
SnCl4,SnBr4 |
HCl+HClO4で加熱,HBr+HClO4で加熱 |
問20
トレーサーの沈殿分離に関する次の記述のうち、正しい組み合わせはどれか。
A 110mAgを塩化物として分離できる。
B 203Hgを硫化物として分離できる。
C 133Baを硫酸塩として分離できる。
D 60Coを炭酸塩として分離できる。
1 ABCのみ 2 ABDのみ 3 ACDのみ 4 BCDのみ 5 ABCDすべて
解答
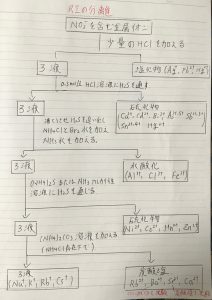
下に示す表を覚えると解きやすくなる。したがって、解答は 1 となる。
a NO3-を含む金属イオンに少量のHClを加える・・・塩化物(Ag+,Pb+,Hg+)と①ろ液に分離される。
b ①ろ液に0.3mol/lのHCl溶液H2Sを通す・・・硫化物(Cu+,Cd+,Bi+,As3+,As5+,Sb3+,Sb5+,Sn2+,Sn4+,Hg2+)と②ろ液に分離される。
c ②ろ液を沸騰させ、H2Sを追い出し、NH4ClとBr2水を加えNH3水を加える・・・水酸化(Al3+,Cl3+,Fe3+)と③ろ液に分離される。
d ③ろ液に(NH4)2SまたはNH3アルカリ水溶液にH2Sを通す・・・硫化物(Ni2+,Co2+,Mn2+,Zn2+)と④ろ液に分離される。
e ④ろ液に(NH4)CO3溶液を加える(NH4Cl存在下で)・・・炭酸塩(Ra2+,Ba2+[クロム塩酸で沈殿],Sr2+[炭酸塩で沈殿],Cu2+)と
ろ液(Na+,K+,Rb+,Cs+)に分離される。

問21
放射化学分離に関する次の記述のうち、正しいものはどれか。
A 64Cu2+と65Zn2+を含む酸性水溶液に鉄片を入れると65Znが析出する。
B ヨウ化エチルを中性子照射して生成する128Iの一部は水相に抽出分離される。
C 沈殿分離では、生成する塩の溶解度積が小さい反応が選ばれる。
D ラジオコロイドは、イオン交換樹脂で分離する。
E 水溶液中のリン酸イオン及び硫酸イオンは、水酸化鉄(III)に共沈する。
1 AとB 2 BとC 3 CとD 4 DとE 5 AとE
解答
A イオン化傾向を覚えておく必要がある。イオン化傾向が大きいと水溶液中に留まるということになる。K>Ca>Na>Mg>Al>Zn>Fe>Ni>Sn>Pb>(H)>Cu>Hg>Ag>Pt>Au となり、Feを入れた時に析出するのはCuである。
B ヨウ化エチルを中性子照射して還元剤を含む水と振とうさせると、生成した128Iが水相に抽出される。よって正しい
C 沈殿分離では、生成する塩の溶解度積が小さい反応を選ぶ・・これは覚えた方が良い。よって正しい
D ラジオコロイドはコロイドなのでイオンとしての挙動は示さず、イオン交換樹脂には吸着しない。しかし、カラム法の時には、ラジオコロイドがカラム先端に沈着することがある。よって今回は誤りとなる。
E リン酸イオンはほとんど完全に共沈するが、硫酸イオンはほとんど共沈しない。よって誤りとなる。
したがって、解答は 2 となる。
問22
33Pで標識されたある化合物の試料を検定した。この化合物として標識されている33Pは772kBqであり、その他に32Pで標識された同じ化合物が16kBq、他の化学形の33Pが12kBq含まれていた。この試料の検定時の核種純度(%)として最も近い値は、次のうちどれか。
1 96.5
2 97.0
3 97.5
4 98.0
5 98.5
解答
放射性核種純度とは、化学系とは関係なく着目する放射性核種が、全物質に占める割合をいう。
ここでは、着目する核種は33Pであることから(核種純度) = (全ての化学形の33P放射能)/試料の全放射能 × 100 = (772+12)/(772+16+12) × 100 = 98%
したがって、解答は 4 となる。
問23
比放射能80Bq/mgの[14C]ベンゼンをニトロ化して得られる[14C]ニトロベンゼンの比放射能(Bq/mg)として最も近い値は、次のうちどれか。
ただし、ベンゼン及びニトロベンゼンの分子量をそれぞれ78及び123とする。
1 39
2 51
3 67
4 80
5 126
解答 比放射能とは放射性核種の属する元素の単位質量当たりの放射能である。ここで[14C]ベンゼンとニトロ化して得られた[14C]ニトロベンゼンの放射能は等しくなるはずである。[14C]ベンゼン質量を m ミリグラムとすると[14C]ニトロベンゼンの求める比放射能Aは次のように計算される。 80 × m = A・m × (123/78) = 80 × (78/123) = 50.7
したがって、解答は 2 となる。
問24
放射性同位元素の化学的挙動に関する次の記述のうち、正しい組み合わせはどれか。
A 90Srを含む水溶液が弱アルカリ性となった場合に、ろ紙でろ過するとろ紙には娘核種の90Yが吸着する。
B 140Baを含む水溶液が弱アルカリ性となった場合に、ろ紙でろ過するとろ紙には娘核種の140Laが吸着する。
C 無担体の58Co(II)を含む水溶液に塩化鉄(III)の水溶液を加えて、アルカリ性にすると、ほとんどの58Co(II)が水酸化鉄(III)と共沈する。
D 無担体の24Naを含む水溶液に塩化鉄(III)の水溶液を加えて、アルカリ性にすると、ほとんどの24Naが水酸化鉄(III)と共沈する。
1 ABCのみ 2 ABDのみ 3 ACDのみ 4 BCDのみ 5 ABCDすべて
解答
A,B共に共沈法による分離であり、覚えておく必要がある。
90Srは1ヵ月以上放置すると、その娘核種の90Yと永続平衡が成立し、90Srと90Yが共存する。この90Yは無担体なので、目に見えず秤量もできない。
そこでアンモニア水を加えて弱アルカリ性にすると90Yはろ紙上に残る。140Baも同様である。
D のNaは、水酸化鉄(III)と共沈はしない。
したがって、解答は 1 となる。
問25
ラジオイムノアッセイ法に関する次の記述のうち、正しい組み合わせはどれか。
A 同位体希釈法の一種である。
B 抗原抗体反応を利用する定量法である。
C 標識核種として123Iが用いられる。
D 簡単な分離操作と放射能測定によって定量できる。
1 ABCのみ 2 ABDのみ 3 ACDのみ 4 BCDのみ 5 ABCDすべて
解答
ラジオイムノアッセイ法とは、放射免疫測定法のことであり、放射性同位体をトレーサーとして利用し、in vitro(試験管内の)検査により生体中の特定物質の量または動態を求める方法である。
A 同位体希釈分析法とは放射性同位体を用いた化学分析法の一つである。化学的性質がよく似ていて完全に分離できないもの、例えば希土類元素、アミノ酸、抗生物質、ステロイド等が定量できる。したがって正しい。
B 抗原抗体反応とは、放射性同位体で標識した抗原と測定しようとする抗体とが、抗体と競合して結合することを利用し、結合した物質の放射能を測定すて微量物質の量を求める。したがって正しい。
C 標識核種として用いられる核種は125Iである。
D ラジオイムノアッセイ法は簡単な分離操作と放射能測定によって定量できるので正しい。
したがって、解答は 2 となる。
問26
化合物 x gを定量するために同一の化学形の標識化合物 y g(比放射能S1)を加えた。これから、同化合物 z gを分離して比放射能を測定
するとS2であった。xを与える式として正しいものは次のうちどれか。
1 [(S1/S2)-1]・y
2 [(S2/S1)-1]・y
3 [(S1/S2)-1]・z
4 [(S2/S1)-1]・z
5 [(S1/S2)-1]・(y-z)
解答
混合前のラベル付き化合物の全放射能と混合後の全放射能は混合前後で等しいので
S1・y = S2・(x + y) x =[(S1 – S2)・y]/S2 よって x = [(S1/S2)-1]・y
したがって、解答は 1 となる。
問27
医療分野で利用される放射性核種に関する次の記述のうち、正しいものの組み合わせはどれか。
A 99mTcの製造には、加速器が必要である。
B 125Iは、ミルキングで製造される。
C 123Iは、シングルフォトン放射断層撮影(SPECT)で用いられる。
D 18Fは、陽電子放射断層撮影法(PET)で用いられる。
1 AとB 2 AとC 3 BとC 4 BとD 5 CとD
解答
A 99mTcは99mMoの娘核種で核異性体転移(IT)によって生じる。99MoはMoO4(2-)の形でアルミナカラムに吸着させ1日位放置すると娘核種の99mTcと過度平衡が成立し、生理食塩水で溶出すると99mTc4-が得られるため誤りとなる。
B ミルキングのジェネレータとしては、90Sr-90Y, 99Mo-99mTc, 113Sn-113mIn なのでこれも誤りとなる。
C SPECT撮影では123Iは脳血流、甲状腺機能、心機能・血流の検査に用いられるためこれは正しい。
D PET検査では18Fは心臓や脳といった機能をみる検査に用いられるためこれも正しい。
したがって、解答は 5 となる。
問28
次の記述のうち、正しい組み合わせはどれか。
A 物質に吸収された放射線のエネルギー100eV当たりに変化する原子、分子またはイオンの数をG値という。
B 気体が放射線により電離される時、1組のイオン対を作るのに必要な平均エネルギーをW値という。
C 水の放射線分解で生成する水和電子は酸化力を示す。
D 高分子に放射線を照射すると、架橋反応や分解反応が起きる。
1 ABCのみ 2 ABDのみ 3 ACDのみ 4 BCDのみ 5 ABCDすべて
解答
A、Bは定義なので覚えておく必要がある。
C の水和電子とは水中に生成した自由電子が、水分子の双極子の作用によって一時的に水分子に束縛されたもの。電荷は-1、多くの物質と
反応して強力な還元性を示す。表に水の放射線分解で生成する化学種の水溶液中での性質を示す。
| 水和電子 |
還元性 |
| Hラジカル |
還元性 |
| H2 |
還元性 |
| OHラジカル |
酸化性 |
| H2O2 |
酸化性 |
高分子に対する放射線の作用は大別して架橋反応と分解反応がある。
したがって、解答は 2 となる。
問29
硫酸セリウム(Ⅳ)の硫酸酸性溶液10gに60Coからのγ線を1時間照射したところ、1.0 × 10^(-5)のセリウム(Ⅲ)が生成した。
この反応のG値を2.5とした時の吸収線量(Gy)として最も近い値は次のうちどれか。ただし、セリウムの原子量は140とする。
1 1
2 3
3 14
4 27
5 55
解答
生成したCe(Ⅲ)の原子数Nは、溶液1 gあたり N = (1.0 × 10^(-5)/10・140)× 6×10^23 となる。
G値が2.5とは100eVのエネルギー吸収によって2.5個のCe(Ⅲ)を生成するので、N個のCe(Ⅲ)が吸収する線量Dは D = (N/2.5)×100 = 0.0274(J/g)
Gyにすると27.4Gyとなる。
したがって、解答は 4 となる。
問30
64Cuの壊変に関する次の記述のうち、正しいものの組み合わせはどれか。
A γ線スペクトルに511keVのピークがみられる。
B 64Znを生成する部分半減期は、64Niを生成する部分半減期より長い。
C EC壊変に伴い、Cuの特性X線が放出される。
D 発生する陽電子の運動エネルギーhが単一である。
E 1346keVのγ線はEC壊変に続いて発生する。

1 ABCのみ 2 ABEのみ 3 ADEのみ 4 BCDのみ 5 CDEのみ
解答
A 正 64Cuはβ+壊変して64Niになる。その際に放出される陽電子は、通常の電子の反物質であるため、運動エネルギーを失って停止すると、物質中の電子と結合して消滅する。その際に消滅放射線と呼ばれる511keVのγ線2本を180°反対方向に放出する。これがγ線スペクトルに現れる。
B 正 放射性核種の中には、2種類以上の壊変を行うものがある。64Cuの壊変もその一つであり、このように枝分かれする壊変を分岐壊変とよび、その割合を分岐比という。分岐した壊変について、それぞれの壊変式が成り立つので、i番目の壊変に着目すると次のように表せる。
dN/dt = -λiN、(T1/2)i = ln2/λi このように定義した半減期を部分半減期という。ここで、この親核種に注目すると、その壊変定数λは次のように表される。
λ = λ1 + λ2 + ・・・λi + ・・・λn この間では、64Cuの壊変定数をλとすると、λ = λ(EC) + λ(β+) + λ(EC) + λ(β-) となり、λ(64Ni) = λ(EC) + λ(β+) + λ(EC) = 0.005λ + 0.174λ + 0.431λ = 0.61λ λ(64Zn) = λ(β-) 0.39λ
それぞれの半減期はT(64Ni) = ln2/0.61λとT(64Zn) = ln/0.39λとなる。したがって、64Znを生成する部分半減期は64Niより長くなる。
C 誤 β壊変では原子核内の陽子が中性子に壊変するとき、陽子が軌道電子を捕獲して中性子に壊変する場合がある。これを電子捕獲あるいはEC壊変という。このときに特性X線あるいはオージエ電子が発生する。ここでの特性X線はNiによるものである。
D 誤 β壊変では壊変のエネルギーが娘原子とβ線とニュートリノの3本に分配されるので、放出されるβ線とニュートリノの角度によりそのエネルギーは異なり、連続分布を示す。
E 正 EC壊変により励起状態になって娘核がγ線を放出し、基底状態に転移する。エネルギーの高い準位と」低い準位のエネルギーをそれぞれEi,Ejとするとγ線のエネルギーEγ = Ei – Ejで与えられる。
したがって解答は 2
イオン交換樹脂

イオン交換樹脂はイオン交換基をもつ高分子であり、水溶液中のイオンと樹脂自身に吸着しているイオンを交換する。イオン交換樹脂が水溶液中のイオンを吸着する強さがイオンによって異なり、この性質を利用してイオンを分離することができる。例えばスチレンー ジビニルベンゼン共重合体を高分子骨格とし、 -S03H 基をイオン交換部位として持つ強酸性陽イオン交換樹脂では +1 価イオンの樹脂への吸着強度は Li+ < Na+ < K+ < Rb+ であり 水和イオン半径が小さいものほど強い。(水和イオン半径は原子番号が大きいほど小さくなる)。また価数が異なるイオンに対しては一般に +1価 < +2価 < +3価 という傾向がある。 イオン交換樹脂に吸着しているイオンと水溶液中のイオンは吸着平衡になる。陽イオン交換樹脂に吸着している A+ イオンの濃度を [A]r 、水溶液中の A+ イオンの濃度を [A]a 、B+ イオンについても同様に行うと、Kr = ([B]r/[B]a)/([A]r/[A]a) という 平衡定数となる。Kr > 1 の時には B+ イオンの方が A+ イオンより強く吸着する。イオン交換樹脂の吸着平衡は、溶液と樹脂吸着のイオンの濃度比を決定し、濃度には依存しないので、無担体の放射性同位体の分離に適している。 一方、強塩基性陰イオン交換樹脂を用いて塩化物イオンとの錯形成能の違いを利用して分離することができる。強塩基性陰イオン交換樹脂カラムに Fe3+,Co2+,Ni2+ を含む 9 mol/l 塩酸溶液を 1ml ,その後 9 mol/l , 4 mol/l , 0.5 mol/l の濃度の塩酸を 順次 12 ml ずつ流して各イオンを分離すると上図のようになった。塩化物イオンとの錯体形成能の強さは Fe3+ > Co2+ > Ni2+ の順であり、a , b , c のピークは左から Ni2+ , Co2+ , Fe3+ である。
放射化学分離について
短半減期の放射性核種の分離では操作時間の短縮が求められる場合がある。例えば、半減期 25 分の 128I の分離について考える。分離法1 では化学収率が 80% で 50 分を要する。これに対して分離法2 の化学収率が 40% とする。分離法2 の所要時間が 25 分だとすると化学分離後の放射能は分離法1 と等しくなる。(半減期 25 分の 128I では、50 分の経過で放射能は 1/4 となる。分離法1 では収率が 80% であるので、化学分離後の 放射能は当初の放射能の 0.25 × 0.8 = 0.2 となる。分離法2 の所要時間を半減期の x 倍とおくと分離法2 では収率が 40% であるから (1/2)^x × 0.4 = 0.2 x = 1 となり、半減期 25 分であるので 25 となる。)放射化学分離では、放射性核種の 化学的状態を変化させて別の相とし、相分離で目的成分を得ることがしばしば行われる。沈殿分離法がその典型である。この場合、目的核種と沈殿を形成する試薬を添加することで水に難容な個体沈殿を形成し、これにろ過や遠心分離 などで固体と液体に分離して放射性核種を回収する。沈殿分離法と類似した方法に共沈分離法がある。沈殿生成に伴って溶液中の放射性核種を沈殿に取り込み、水溶液から分離する。鉛、スズ及びアンチモンの放射性核種を塩酸酸性溶液から同時に共沈する CuS がある。また (32PO4)3- と (35SO4)2- の共存する水溶液から (32PO4)2- のみが共沈する Fe(OH)3 も知られている。